人類身體內的微生物數量有多少?
目前,我們體內存在著超過一千種微生物物種,大約有100兆個微生物,而人類體內的細胞總數預估可達到37.2兆個,也就是說人體內微生物的總數與體內的細胞總數相比,比值是3:1 (也有研究表示人體內的細胞總數為10兆個,因此100兆個微生物的總數與10兆的細胞總數相比,比值是10:1)。微生物組現在被認為是人體的一個虛擬器官。人類基因組由大約23,000個基因組成,而微生物組編碼超過300萬個基因,產生數千種代謝物,這些代謝物取代宿主的許多功能,從而影響宿主的健康。
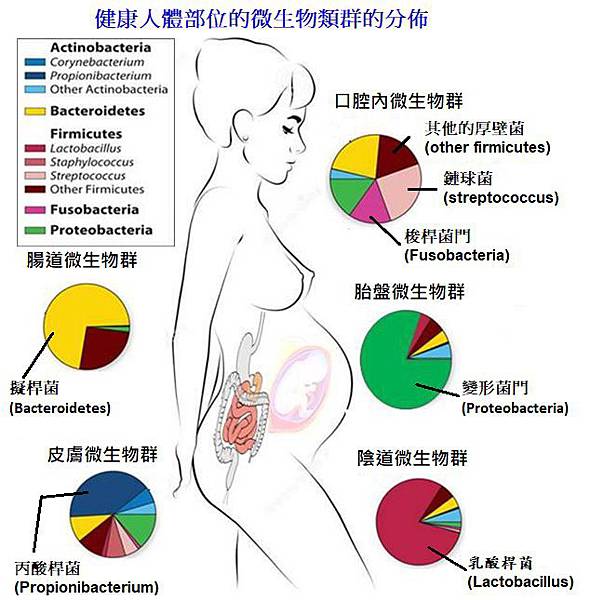
哪些身體的地方有微生物群(microbiomes) ?
包括皮膚、鼻腔、口腔、胃腸道、泌尿及生殖道,都可以發現微生物
圖片來自:Belizário JE and Napolitano M. (2015),Human microbiomes and their roles in dysbiosis,common diseases,and novel therapeutic approaches. Front. Microbiol.6:1050.
身體內的微生物群(microbiomes) 有哪些種類?
體內的微生物組不僅包括細菌,還包括病毒,原生動物和真菌。其中細菌是數量最大的一群。細菌可以分類為需氧菌(aerobes),厭氧菌(anaerobes),或兼性厭氧菌(facultative anaerobes)。厭氧菌(anaerobes)僅能進行無氧呼吸,無法像需氧菌(aerobes)在正常大氣(氧含量21%)環境下存活,厭氧菌(anaerobes)的無氧呼吸和發酵產生的能量(即ATP)比有氧呼吸要低,這也是兼性厭氧菌在氧氣充足的條件下優先進行有氧呼吸的原因兼性厭氧細菌例如乳桿菌,葡萄球菌和大腸桿菌,能夠在有氧或無氧的情況下產生能量 ATP。
到目前為止,只有一小部分微生物被成功培養,還有數千個尚未被完全測序,需要日後進行更深層次的分類學分析以利瞭解菌株種類和基因組的分析。
身體內的細菌菌種有哪些種類?
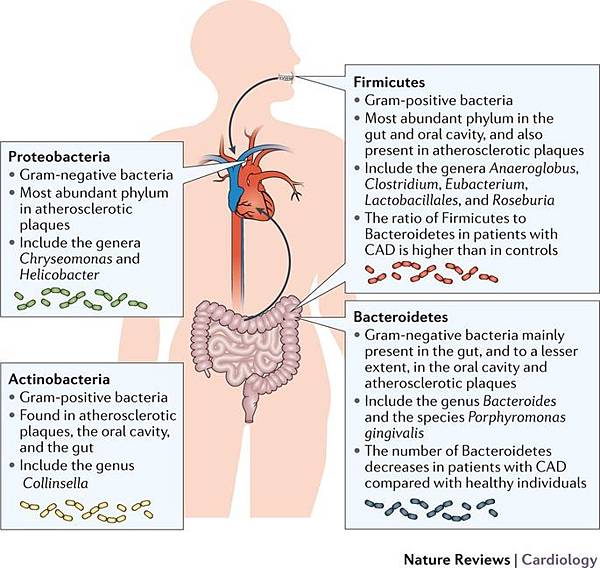
體內的細菌主要可分為四個類別 1)厚壁菌門(Firmicutes),2)擬桿菌(Bacteroidetes) 3)放線菌(Actinobacteria),和4)變形菌門(Proteobacteria)。厚壁菌門(Firmicutes)及擬桿菌(Bacteroidetes)佔腸道微生物組約90%以上。
1)厚壁菌門(Firmicutes)是一個多樣化的門,主要由Bacilli和Clostridia類組成。它們是革蘭氏陽性,包括需氧菌(aerobes),厭氧菌(anaerobes),或兼性厭氧菌(facultative anaerobes)。
2) 擬桿菌(Bacteroidetes)由革蘭氏陰性,非孢子形成厭氧細菌組成,耐受氧氣但不能用於生長。
3)放線菌(Actinobacteria)例如雙歧桿菌是革蘭氏陽性,多分枝桿,非運動,非孢子形成和厭氧細菌。
4)變形菌門(Proteobacteria)例如,埃希氏菌屬,克雷伯氏菌屬,腸桿菌屬。是需氧或兼性厭氧,革蘭氏陰性,非孢子形成的桿菌,其棲息在所有脊椎動物的腸道中。
圖片來自: Jonsson Lindskog A. et al, Role of gut microbiota in atherosclerosis, Nature Reviews Cardiology volume 14, pages 79–87 (2017)
身體內的微生物群(microbiomes)有哪些功能?
1)產生能量 2)維生素生成 3)抗炎反應
1)產生能量
人類的進化與人類腸道微生物群的共生夥伴關係有關,基本上人類的腸道是無法分解消化纖維的,可是某些細菌卻是依賴分解纖維維生,然後再攝取使用它們需要的養分。而某些纖維分解產物,例如短鏈脂肪酸(short-chain fatty acid, SCFA)則可以被腸道吸收使用。腸道中的糖分解細菌發酵(Saccharolytic bacterial fermentation)通常產生有益的代謝產物,而如果碳水化合物含量有限,細菌轉向替代能源,導致其他代謝產物的產生,這可能對人類健康更有害。膳食食物發酵後細菌發酵的關鍵產物是短鏈脂肪酸(short chain fatty acids, SCFA)包括乙酸(acetate), 丙酸(propionate), 以及丁酸(butyrate)和氣體(包括甲烷,硫化氫)。其中乙酸/丙酸/丁酸在腸道中恆定的比例關係約60:25:10。
- 丁酸(butyrate)具有四個碳,可說是人類健康最重要的短鏈脂肪酸(SCFA)。主要在腸上皮中代謝產生酮體(ketone body)或CO2,它形成人類結腸細胞的關鍵能量來源,結腸上皮細胞直接從丁酸(butyrate)中獲得高達70%的能量需求。丁酸(butyrate)也具有潛在的抗癌活性,主要是可以誘導結腸癌細胞凋亡的能力。還有證據顯示丁酸(butyrate)可通過cAMP依賴性機制活化腸道葡萄糖生成作用(gluconeogenesis,IGN),對葡萄糖和能量動態穩定具有有益作用。
- 丙酸(propionate)具有三個碳,是上皮細胞的能量來源,在腸道及肝臟進行葡萄糖生成作用(gluconeogenesis,IGN)將丙酸(propionate)轉換成葡萄糖,同時會減少肝臟製造葡萄糖。因而直接促進能量動態穩定,進而減少體內有過多的葡萄糖,最後減少肥胖的風險。
- 乙酸(acetate) 具有兩個碳,是最豐富的短鏈脂肪酸(SCFA),是其他細菌生長的必需輔因子/代謝物。在人體內,乙酸(acetate)會被骨骼肌和心肌使用,也會被轉運到末梢組織,用於膽固醇代謝和脂肪生成。
2)維生素生成
微生物組中的細菌有助於消化我們的食物,調節我們的免疫系統,防止其他導致疾病的細菌,並產生維生素。大多數人類飲食提供許多的維生素供應,維生素是必須從外源獲得的人體必需營養素。然而,腸道微生物也有助於維生素合成。在遠端腸中常見的幾種細菌屬,例如擬桿菌(Bacteroides),雙歧桿菌(Bifidobacterium)和腸球菌(Enterococcus)會合成維生素包括硫胺素(thiamine, B1),葉酸(folate, B9),生物素(biotin, B7),核黃素(riboflavin, B2)和泛酸(panthothenic acid, B5)等水溶性維生素,這些維生素在飲食中含量豐富,但也經由腸道細菌合成。同樣,據估計,每天血液凝固所需的維生素K需要量的一半是由腸道細菌提供的。
3)抗炎反應
有一部分常駐為腸道的微生物群不易誘發炎症,甚至某些分類群可能具有抵抗炎症的能力。這種看似抑制炎症的效果可能是源自不同行為的結果。微生物群的炎症抑制部分可以(1)對抗一些炎症加重細菌,這將減少系統的炎症張力,(2)改善胃腸粘膜的屏障作用,使內腔中較少引起炎症的微生物成員可轉移到體內(3)直接與驅動炎症的微生物成員相互作用。這三個動作可能同時起作用
目前研究最多的為腸道微生物群的炎症抑制分類群是乳酸桿菌(Lactobacillus)和雙歧桿菌(Bifidobacterium)的某些物種/菌株,並且那些也是通過施用益生菌(攝取時產生健康有益效果的活微生物)或某些膳食來支持的部分。選擇性刺激常駐乳酸桿菌和雙歧桿菌(益生元)的纖維。腸道暴露於特定細菌菌株可以抑制不希望的免疫反應,例如過敏和自身免疫反應,或以更廣泛的免疫刺激方式起作用,與腸道非特異性IgA分泌增加有關。
此外腸道的微生物也有助於調節免疫系統的動態平衡,例如有些腸道微生物會對促進抗病原菌感染反應的Th17細胞增加,另外其他的腸道微生物會導致抑制過度產生發炎反應的T細胞(Treg)增加。因此腸道微生物的多樣性,會讓腸道免疫系統達到穩定的動態平衡。
參考文獻
- J. E. Belizario and M. Napolitano, “Human microbiomes and their roles in dysbiosis, common diseases, and novel therapeutic approaches,” Frontiers in Microbiology, vol. 6, p. 1050, 2015
- Belizario, Joe & Faintuch, Joel & Garay-Malpartida, Miguel. (2018). Gut Microbiome Dysbiosis and Immunometabolism: New Frontiers for Treatment of Metabolic Diseases. Mediators of Inflammation. 2018. 1-12
- Belizário, J. E., Faintuch, J., and Garay-Malpartida, M. (2018). Gut Microbiome dysbiosis and immunometabolism: new frontiers for treatment of metabolic diseases. Mediat. Inflamm. 2018:2037838.
- Rowland, Ian et al. “Gut microbiota functions: metabolism of nutrients and other food components.” European journal of nutrition vol. 57,1 (2017): 1-24.
- Belkaid Y, Hand TW. Role of the microbiota in immunity and inflammation. Cell. 2014;157:121–41.
- Hooper, Lora V et al. “Interactions between the microbiota and the immune system.” Science (New York, N.Y.) vol. 336,6086 (2012): 1268-73.
- Morowitz, Michael J et al. “Contributions of intestinal bacteria to nutrition and metabolism in the critically ill.” The Surgical clinics of North America vol. 91,4 (2011): 771-85, viii.


 留言列表
留言列表